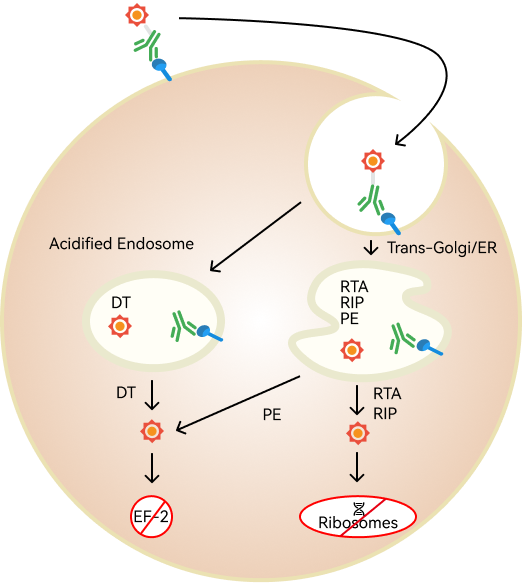
VG712是一种由二价抗CD3抗体结合域与经过改造的白喉毒素融合而成的免疫毒素蛋白,可与T细胞特异性结合后经内吞作用进入细胞,在胞内释放毒素引起T细胞死亡

1不同于单克隆抗体,scFV不含 Fc 结合点位,因此不会触发危及生命的细胞因子风暴
2改造后的毒素对阴性 CD3 细胞的毒性降低了 1000 倍
3体内的半衰期仅 40 分钟,降低了感染和患其他并发症的风险
1由于 CD3 几乎在所有成熟 T 细胞表面均有表达,因此VG712可清除几乎所有 T 细胞亚群。
2二价结构提高了亲和力和生物活性
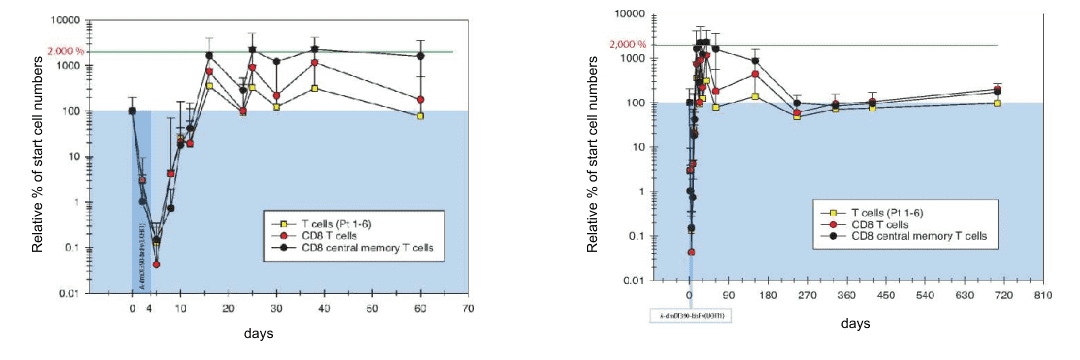
3药效强,治疗周期短:4 天治疗即可清除血液中 99%以上 的 T 细胞

David Neville教授团队完成分子设计及验证
获得发明专利的全球授权
开创免疫毒素领域的研究先河
针对CD3靶点的二价毒素蛋白分子构建和机理验证
打通和简化生产工艺

从NIH获得了Resimmune®的开发授权
完成皮肤T细胞淋巴瘤的临床I期研究,获得FDA孤儿药资格、快速审批资格
与路易斯维尔大学(U. Louisville)合作启动抗 PD-1 联合疗法研究
与科罗拉多大学(U. Colorado)合作,在猴子上验证了肾器官移植后不依赖免疫抑制剂的长期生存

NIH批准将Resimmune®全球独家商业开发权由Angimmune公司转移至维瑾生物
CMC开发已完成,药品即可准备进行大规模临床试验
CTCL的II期关键性临床获FDA批准
aGvHD、PTCL的I期临床获得FAD批准
肾移植 I/II期临床试验方案已提交 IND 申请
与美国莫菲特癌症中心(Moffitt Cancer Center)达成战略合作协议

在24名受试的CTCL患者中,有19 名患者处于1b-2b 期,而其余5 名患者处于3-4 期总体完全缓解率 (CRR) 为 17%,高于现有治疗方法所能达到的水平
12 名中期患者(根据 mSWAT 病灶大小评分)的治疗效果尤为突出:CRR 高达 33%,其中 3 名患者的完全缓解持续时间超过 6 年,1 名患者完全缓解持续时间超过 4 年